多鳍鱼Shh基因克隆与同源性分析
发布时间:2009年07月27日 作者:张昌盛
北京自然博物馆 张昌盛
[摘要]根据已报道的软骨鱼、硬骨鱼、两栖类、鸟类、哺乳类和人的Sonic hedgehog (Shh)基因序列,在Shh基因保守区设计一对简并性引物,利用PCR技术从多鳍鱼cDNA中扩增Shh基因。结果显示,多鳍鱼Shh基因全长1263bp,编码421个氨基酸。通过同源性比较发现,多鳍鱼与肺鱼的同源性最高,为82.5%,二级结构分析表明,Shh蛋白含有30.71%的α螺旋,21.67%的扩展线条和47.62%的无规卷曲,不含β片层;并以蛋白质结构数据库(PDB)中已解析的Shh蛋白的三维结晶结构(3D)为模板,利用http://www.expasy.org/swis smod/SWISS- MODEL.html 同源模建Shh蛋白的三维结构,为进一步研究Shh基因在胚胎体节发育和肢芽图式形成中的功
能奠定了基础。
[关键词] 多鳍鱼;Shh基因;分子进化;同源性分析
Hedgehog(Hh)是果蝇发育中一种必需的体节极性基因[1],Hedgehog编码的蛋白在胚胎体节发育和肢芽图式形成中起着重要作用[2-4],在高等脊椎动物中,Hedgehog基因家族至少含有Shh(Sonic hedgehog)、Ihh(Indian hedgehog)、Dhh(Desert hedgehog)3种成分[3- 6]。
音猬因子(Sonic hedgehog, Shh)是Hh在脊椎动物中的同源基因之一,是胚胎发育过程中由脊索产生的一种因子,已相继在斑马鱼、鸡、鼠、人等不同物种中被发现[7]。Shh是Hh家族中表达最广泛的基因,在Hh信号传导通路中起主要作用。分泌性糖蛋白Shh作为一种胞外信号因子[8]参与脊椎动物胚胎发育的许多过程,它与细胞在肢体、体节、神经管发育中的分化建立有关,调节着神经管D-V( dorsal- ventral)发育模式、肢体A-P( anterior- posterior)发育模式、胚胎早期不对称发育模式和体节形成模式[9],与多种器官如脑、脊索、肺脏、毛发、眼、颌面结构、牙齿、四肢等的形态形成有关[10-12]。
多鳍鱼( Senegal bichir)的背鳍由一列尖棘状小鳍组成,每1小鳍由1鳍轴骨支持着,并有一前后扁平的硬鳍条;臀鳍较短,位于鱼体的后下部;胸鳍基部呈肉质叶;腹鳍肉质叶较胸鳍小,距胸鳍较远;尾鳍呈歪形。多鳍鱼体被菱形的厚硬鳞覆盖, 是远古时代遗留下来的鱼类之一,由于其在进化关系上的地位特殊,所以有活化石之称。为了探明Shh基因的结构和定义该基因能否作为分子信标基因,本文从多鳍鱼的cDNA中克隆了Shh基因(Sebi-Shh), 并对其基因序列与氨基酸序列进行了分析,为进一步研究多鳍鱼分子进化规律奠定了基础。
1 材料与方法
1.1 多鳍鱼
本文共使用12尾多鳍鱼。
1.2 RNA提取与cDNA合成
首先用Trizol试剂(GibcoRBL)从多鳍鱼肌肉组织中提取总RNA,以总RNA为模板, 用pd(N)6 随机引物、First - Strand cDNA Synthesis 试剂盒( Pharmacia Biotech) 反转录合成第一链cDNA(fcDNA)。
1.3 简并性引物设计
根据已报道的软骨鱼、硬骨鱼、两栖类、鸟类、哺乳类和人的Shh基因序列,在Shh基因保守区设计一对引物。上游引物:5'- ATGCKGCTBHKGACVAGA- 3';下游引物: 5' - TCAVCTBGVVKDTACYCMCAT- 3'。其中K代表T或G;B代表G, T或C;H 代表T, C或A;V 代表A或G;D 代表G,T或A;Y代表T或C;M代表A或C。
以fcDNA为模板,用上、下游引物, 参照TakaRa ExTaq PCR 试剂盒( TakaRa) 进行PCR扩增。PCR反应总体积为50μL,模板添加量为0~5μg。PCR程序如下: 首先98℃热变性8 min,加入ExTaq酶;再94℃热变性1min,然后55℃退火1min、72℃延伸3min。PCR 反应在PCR Express仪上进行30个循环。反应产物经2%琼脂糖电泳,用GENECLEAN试剂盒(BIO101)回收1200bp左右的条带,然后与T-Easy载体(Promaga)连接,转化JM109感受态细胞;再用QIAEX Ⅱ试剂盒(QIAGEN)纯化重组质粒,用ABI PRISM Big Dye Primer Cycle Sequencing Ready Reaction试剂盒和ABI 377 型DNA自动测序仪(Perkin Elmer公司)从T7引物端测定阳性克隆基因序列。
1.4 Shh 基因序列分析与分子进化系统树的构建根据已报道的软骨鱼、硬骨鱼、两栖类、鸟类、哺乳类和人Shh氨基酸序列,利用DNAman 软件,采用UPG法绘制分子系统树。
1.5 Shh基因二级结构的预测与三级结构的同源构建
应用EXPASY 服务器(http://www.expasy.ch/tools/)上的GOR法预测Shh蛋白的二级结构。以蛋白质结构数据库(PDB)中已解析的Shh蛋白的三维结晶结构(3D)为模板,利用http://www.expasy.org/swissmod/SWISS-MODEL.html 同源模建Shh蛋白的三维结构,应用Rasmol法分析软件绘制其结构图。
2 结果
2.1 Shh基因的扩增与酶切鉴定
以多鳍鱼cDNA为模板,用上、下游引物进行PCR扩增,产物经1%琼脂糖凝胶电泳,在1200bp左右处有一特异性条带。将扩增产物回收、纯化,插入T载体,经EcoRI酶切鉴定,在大约3000bp和1200bp处分别有一条特异性的条带,与预期结果相符( 图1) 。
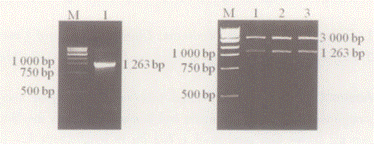
图1 Shh 基因的扩增与酶切鉴定
Fig. 1 Electrophores is of Shh gene RT- PCR product and
recombinant T- easy- vectors diges ted by EcoRI
2.2 Shh基因序列分析
将鉴定阳性克隆进行基因测序,并输入DDBJ/EMBL/GenBank 进行blast比对分析,结果显示,多鳍鱼Shh基因全长1263bp,编码421个氨基酸,在第24,51,102,183,198,345和373位氨基酸处分别含有一个半胱氨基酸,可以形成3对二硫键,结果如图2所示。

图2 Shh 基因序列分析
Fig. 2 Nucleotide sequence and amino acid of Shh gene from sanegal bichir
2.3 Shh基因同源性比较
将多鳍鱼Shh氨基酸序列与已报道的软骨鱼、硬骨鱼、两栖类、鸟类、哺乳类和人Shh氨基酸序列进行比较,结果发现:多鳍鱼与爬行类的同源性最高,达82.3%;和哺乳类的同源性在65.9%~66.4%之间(图3)。值得一提的是,所有动物的Shh基因在1~200氨基酸处高度保守,同源性达90%以上。这可能是脊椎动物所特有的保守区域,还没有研究表明无脊椎动物的Shh基因有相应的结构。

图3 Shh 氨基酸序列比较分析
注: “*”表示缺失; “- ”表示同源
Fig. 3 Alignment of Shh gene from the senegal bichir and different vertebrate
Note: "*"absent; "- "homoloyous
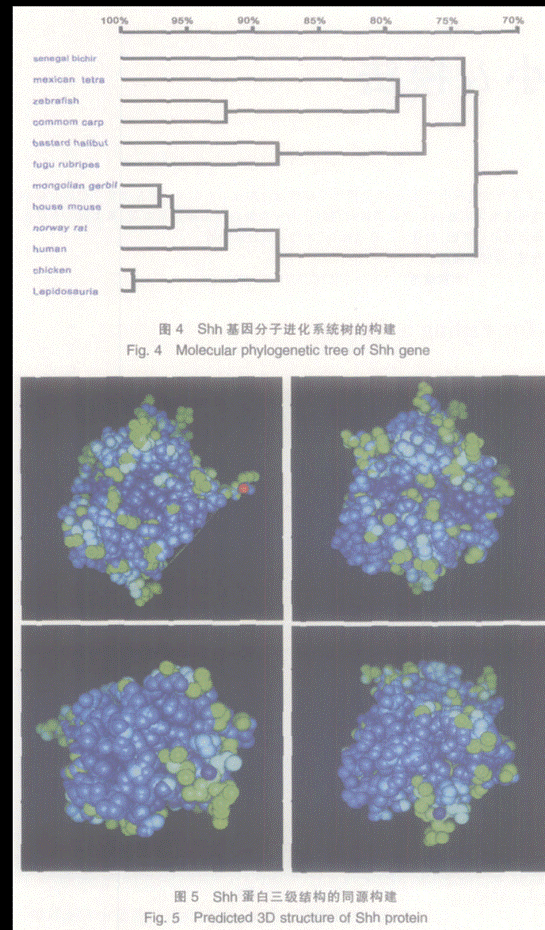
2.4 Shh基因分子系统进化树的构建
根据已报道的软骨鱼、硬骨鱼、两栖类、鸟类、哺乳类和人Shh氨基酸序列,利用DNAman软件,采用UPG法绘制分子系统树,结果如图4所示。
2.5 Shh基因二级结构的预测与三级结构的同源构建
应用EXPASY服务器上的GOR法预测Shh蛋白的二级结构,Shh蛋白含有30.71%的α螺旋,不含β片层,21.67%的扩展线条和47.62%的无规卷曲;并以蛋白质结构数据库( PDB)中已解析的Shh蛋白的三维结晶结构(3D)为模板,利用http://www.expasy.org/swissmod/SWISS-MODEL.html同源模建Shh蛋白的三维结构,结果如图5所示。
3 讨论与结论
Shh是胚胎发育过程中由脊索产生的一种因子,它是一种重要的发育调控因子,参与体内多种发育过程,包括神经管的定型、肢体的发育、细胞表型的定向诱导等[2]。本研究首先克隆了在动物进化上有特殊位置的多鳍鱼Shh基因,对其多态性、三级结构进行了量化分析。Shh基因分子系统进化树所表现出的物种之间的亲缘关系与传统形态学研究得到的结果有很高的符合率。本文的研究结果表明: Shh基因可以作为一种可靠的分子信标基因用于对动物分类学的研究,为进一步进行多鳍鱼的进化研究奠定了基础。
参考文献
[1] NUSSLEIN- VOLHARD C, IESCHAUSE. Mutations affecting segment number and polarity in Drosophila [J].Nature, 1980, 287: 795- 801.
[2] SPINELLA- JAEGLE S, RAWADI G,KAWAI S, et al. Sonic hedgehog increases the commitment of pluripotent mesenchymal cells into the os -teoblas tic lineage and abolishes adipocytic differentiation [J]. J Cell Sci, 2001, 114: 2085- 2094.
[3] ALTABA A R. Catching a gli- mpse of hedgehog [J]. Cell, 1997, 90: 193 - 196.
[4] YAMAGUCHI A, KOMORI T, SUDA T,et al. Regulation of os teoblas t differentiation
mediated by bone morphogenetic proteins ,hedgehogs and cbfal[J]. Endoc Rev, 2000, 21 (4): 393-411.
[5] McMAHON A P. More surprises in the hedgehog s ignaling pathway [J].Cell, 2000, 100: 185-188.
[6] TAIPALE J , BEACHY P A. The hedgehog and wnt s ignaling pathways in cancer[J]. Nature, 2001, 411:349- 354.
[7] POWNALL M E. More to patterning than sonic hedgehog [J]. Bioes say,1994, 16(6): 381-383.
[8] INGHAM P W. Transducing hedgehog:the s tory so far [J]. EMBO J ,1998, 17(13): 3505- 3511.
[9] INGHAM P W, MCMAHON A P.Hedgehog s ignaling in animal development:Paradigms and principles(Review)[J]. Genes Dev, 2001, 15(23): 3059-3087.
[10] MILENKOVIC L, GOODRICH L V,HIGGINS K M, et al. Mouse patched1 controls body s ize determination and limb patterning [J].Development, 1999, 126(20): 4431-4440.
[11] MING J E, ROESSLER E, MUENKE M. Human developmental disorders and the sonic hedgehog pathway [J].Mol Med Today,1998,4(8):343-349.
[12] NASRALLAH I, GOLDEN J A. Brain, eye, and face defects as a result of ectopic localization of Sonic hedgehog protein in the developing ros tral neural tube [J]. Teratology, 2001, 64(2): 107-113.



 京公网安备11010102006642号
京公网安备11010102006642号